خلاصه
برای تبدیل منابع غذایی به انرژی مصرفی، جانداران نیازمند اکسیژن هستند. اهمیت اساسی اکسیژن برای قرنها مورد توجه بوده اما اینکه چطور سلولها به تغییر سطح اکسیژن سازگار میشوند برای مدت زیادی نامعلوم بود.
Gregg L. Semenza، Sir Peter J. Ratcliffe و William G. Kaelin دریافتند چگونه سلولها تغییرات سطح اکسیژن را حس میکنند و با آن سازگار میشوند. آنها یک آبشار مولکولی را شناسایی کردند که فعالیت ژنها را در پاسخ به سطح اکسیژن تنظیم میکند.
این دانشمندان بنیان فهم امروزی ما از نحوه متاثر شدن متابولیسم و فعالیت فیزیولوژیک سلولی از سطح اکسیژن را شکل دادند. آنها همچنین راه را برای طراحی روشهای جدید مبارزه با آنمی، سرطان و بیماریهای دیگر هموار کردهاند.
نویسنده: پریسا ایلون
اکسیژن
اکسیژن با فرمول شیمیایی O2 نزدیک به یک پنجم از اتمسفر زمین را تشکیل میدهد. اکسیژن برای زندگی جانداران لازم است و در میتوکندری سلولی مصرف میشود. تقریبا در تمام سلولهای بدن جانداران میتوکندری وجود دارد و منابع غذایی را به انرژی قابل مصرف تبدیل میکند. Otto Warburgبرنده جایزه نوبل فیزیولوژی و پزشکی سال 1931، نشان داد که این تبدیل یک پروسه آنزیمی است.
طی تکامل، مکانیسمهایی ایجاد شد که اکسیژن مورد نیاز سلول و بافت را تامین میکرد. رگ کاروتید که نزدیک عروق بزرگ خونی در دو طرف گردن است، دارای سلولهایی است که مخصوص دریافت میزان اکسیژن خون هستند. Corneille Heymans در سال 1938 به دلیل دست آوردهای علمی خود در توضیح نحوه تنظیم سرعت تنفس در پاسخ به میزان اکسیژن خونی شناسایی شده در کاروتید و ارتباط مستقیم آن با مغز، جایزه نوبل فیزیولوژی و پزشکی را دریافت کرد.
HIF
علاوه بر کنترل سطح پایین اکسیژن توسط کاروتید روشهای سازگاری دیگری هم وجود دارند. یکی از مهمترین آنها افزایش سطح هورمون اریتروپویتین است که منجر به تولید گلبولهای قرمز میشود. اهمیت هورمون اریتروپویتین در اوایل قرن بیست مشخص شد اما اینکه چطور خود هورمون تحت تاثیر اکسیژن پایین است نامعلوم ماند.
Gregg Semenza ژن مربوط به هورمون EPO و کنترل بیان آن با سطوح مختلف اکسیژن را مطالعه کرد. با مطالعه موش تغییر ژنتیکی یافته، نشان داده شد توالی خاصی از DNA که نزدیک به ژن EPO قرار داشتند پاسخ به هایپوکسیا(کمبود اکسیژن) را تنظیم میکنند. Peter Ratcliffe تنظیم ژن EPO وابسته به اکسیژن را مطالعه کرد و هر دو گروه پژوهشی دریافتند که مکانیسمهای تشخیص اکسیژن تقریبا در تمام بافتها وجود دارد نه فقط در سلولهای کلیه که در آن EPO به طور طبیعی تولید میشود. این نکته مهم بود چون نشان میداد که یک مکانیسم عمومی وجود دارد که در سلولهای مختلف عملکرد دارد.
Semenza امیدوار بود که عوامل سلولی ایجاد کننده این پاسخ را بیابد. با مطالعه سلولهای کبدی کشت یافته او دریافت یک نوع کمپلکس پروتئینی وجود دارد که به طور وابسته به میزان اکسیژن به DNA تعیین شده متصل میشود. او این کمپلکس پروتئینی را HIF نامید. تلاشهای بسیار برای استخراج HIF شروع شد و Semenza توانست برخی از یافتههای اصلی خود را منتشر کند از جمله ژنی که HIF را کد میکرد. نشان داده شد که HIF از به هم پیوستن دو پروتئین متصل شونده به DNA مختلف تشکیل شده است که امروزه HIF-1α و ARNT نامیده میشوند. اکنون دانشمندان میتوانستند با تعیین سایر عوامل درگیر و توضیح نحوه عملکرد این سیستم معما را حل کنند.
VHL
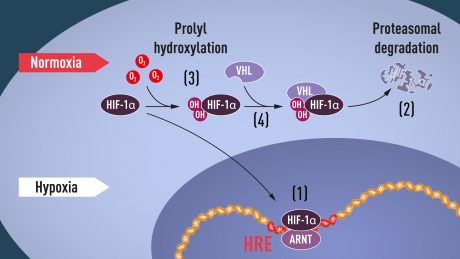
زمانی که سطح اکسیژن بالا باشد سلولها دارای میزان کمی HIF-1α هستند. اما وقتی سطح اکسیژن کم باشد میزان HIF-1α افزایش مییابد به طوری که میتواند با ژن EPO باند شود و آن را تنظیم کند و البته ژنهای دیگری هم با DNA متصل شونده به HIF باند میشوند. گروههای پژوهشی متعددی نشان دادند HIF-1α که به طور نرمال سریع از بین میرود هنگام هایپوکسی در سلول حفظ میشود. در سطوح اکسیژن نرمال، یک ماشین سلولی به نام پروتئوزوم HIF-1α را از بین میبرد. تحت این شرایط یک پپتید کوچک به نام ubiquitin به پروتئین HIF-1α اضافه میشود. فعالیت ubiquitin به عنوان یک علامت پروتئینی برای از بین بردن در پروتئوزوم مقدور شده است. اما سوال باقی مانده این بود که چطور ubiquitin به طور وابسته به اکسیژن به HIF-1α متصل میشود.
پاسخ جایی غیرقابل پیش بینی بود. هم زمان با Semenza و Ratcliffe که در حال بررسی تنظیم ژن EPO بودند، دانشمند، William Kaelin در پی بررسی یک سندرم وراثتی به نام von Hippel-Lindau’s disease (VHL disease) بود. این بیماری ژنتیکی منجر به ریسک افزایش یافته ابتلا به نوعی سرطان در خانوادههایی که جهش وراثتی VHL دارند میشود. Kaelin نشان داد که ژن VHL پروتئینی را کد میکند که مانع از شروع سرطان میشود. او همچنین نشان داد که سلولهای سرطانی کمبود ژن فعال VHL دارند و به طور غیر طبیعی بیان افزایش یافتهی ژنهای تنظیم شونده با هایپوکسی دارند. اما وقتی که ژن VHL دوباره به سلولهای سرطانی داده شد سطح نرمال حفظ میشد. این نشانه مهمی بود و بیان میکرد VHL پاسخ به هایپوکسی را کنترل میکند. یافتههای دیگر توسط سایر گروههای پژوهشی نشان میداد VHL بخشی از یک کمپلکس است که پروتئینها را با ubiquitin نشانهگذاری میکند و آن را برای شکسته شدن در پروتئوزوم آماده میکند. Ratcliffe و تیم او دریافتند VHL میتواند به طور فیزیکی با HIF-1α تعامل داشته باشد و برای شکسته شدن آن در سطح اکسیژن نرمال لازم است. به این ترتیب با قطعیت ارتباط بین HIF-1α و VHL تعیین شد.
اکسیژن تعادل را شیفت میکند
تکههای بسیاری از پازل جای خود قرار گرفته بودند اما چیزی که کم بود این بود که چطور سطح اکسیژن ارتباط بین VHL و HIF-1α را تنظیم میکند. پژوهشهای دیگر متمرکز شد روی قسمت خاصی از پروتئین HIF-1α که برای شکسته شدن وابسته به VHL مهم بود و از طرفیKaelin و Ratcliffe فکر میکردند که کلید اصلی تشخیص اکسیژن جایی درون این دومین پروتئینی است. در سال 2001 در دو مقاله همزمان منتشر شدند که نشان دادند تحت سطوح نرمال اکسیژن گروههای هیدروکسیل در دو موقعیت خاص به HIF-1α افزوده میشوند. این تغییر پروتئین که prolyl hydroxylation خوانده میشود اجازه میدهد VHL ، HIF-1α را شناسایی کند و به آن متصل شود، به این ترتیب توضیح دادند چطور سطح نرمال اکسیژن شکسته شدن سریع HIF-1α را با استفاده از آنزیمهای حساس به اکسیژن کنترل میکند. پژوهشهای بعدی توسط Ratcliffe و دیگران آنزیم prolyl hydroxylases درگیر در این واکنش را تعیین کرد. همچنین مشخص شد ژنی که فعالیت HIF-1α را فعال میکند خود توسط هیکدروکسیله شدن وابسته به اکسیژن تنظیم میشود.
اکسیژن فیزیولوژی و پاتولوژی را شکل میدهد
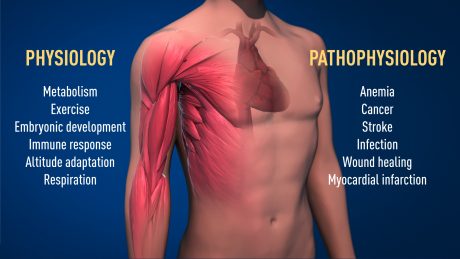
اکنون با این یافتهها میدانیم چطور سطح اکسیژن روندهای فیزیولوژیکی اساسی را تنظیم میکند. دریافت سطح اکسیژن اجازه میدهد سلول متابولیسم خود را با سطح کم اکسیژن هماهنگ کند. برای مثال، در عضلات ماهیچه هنگام فعالیت شدید ورزشی. از دیگر مثالهای سازگاری تنظیم شونده با اکسیژن، ایجاد عروق خونی جدید و تولید گلبول قرمز خونی است. سیستم ایمنی ما و بسیاری از فعالیتهای فیزیولوژیک دیگر به همین ترتیب با اکسیژن تنظیم میشوند. حتی سطح اکسیژن با تعیین شکلگیری طبیعی عروق خونی و جفت در تکامل جنینی هم نقش دارد.
اکسیژن در بیماریهای بسیاری نیز درگیر است. برای مثال بیماران با آسیب مزمن کلیوی به دلیل کاهش بیان EPO از آنمی شدید رنج میبرند. EPO در سلولهای کلیه تولید میشود و در ایجاد گلبولهای قرمز خون ضروری است. به علاوه، ماشین تنظیم شونده با اکسیژن در بیمای سرطان بسیار مهم است. در تومورها ماشین تنظیم شونده با اکسیژن ایجاد عروق خونی را تحریک میکند و متابولیسم را برای تقسیم بالای سلولهای سرطانی ایجاد میکند. اکنون تلاش بسیاری در آزمایشگاهها و شرکتهای دارویی انجام میشود تا دارویی طراحی کنند که با فعال کردن یا مهار کردن ماشین اکسیژنی با بیماری مقابله کند.









دیدگاه ها